
Tempo de Leitura: 7 minutos
Como a Química Impulsiona a Engenharia Genética e Suas Aplicações
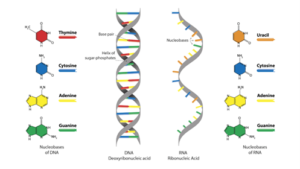
O DNA é um polímero composto por quatro bases nitrogenadas: adenina (A), timina (T), citosina (C) e guanina (G). Essas bases se emparelham de forma complementar (A com T, C com G) e formam uma fita dupla estável, organizada em sequências que codificam proteínas. Ao entender a organização dessas sequências, é possível alterar, remover ou inserir segmentos específicos, modificando a expressão de genes ou as características de uma proteína.
Algumas das principais ferramentas moleculares utilizadas atualmente incluem:
- Enzimas de restrição: endonucleases bacterianas que reconhecem sequências específicas de DNA e realizam cortes precisos. Cada enzima tem uma região-alvo definida, possibilitando o isolamento ou remoção de trechos desejados.
- CRISPR-Cas: sistema derivado do mecanismo imune de bactérias, em que uma endonuclease é guiada por RNA para clivar regiões-alvo do DNA. É versátil, de baixo custo e amplamente utilizado para edição e regulação gênica.
- Enzimas de fusão: proteínas projetadas com domínios funcionais distintos, como regiões de reconhecimento de DNA acopladas a domínios catalíticos. Permitem edições mais controladas e específicas do material genético.
A base química da manipulação genética
A manipulação do material genético depende de fundamentos químicos específicos. A compreensão das propriedades moleculares dos ácidos nucleicos e proteínas permite a construção de ferramentas e estratégias eficientes para a engenharia genética.
A síntese de nucleotídeos, essenciais para sondas e primers utilizados em PCR e clonagem, exige alto controle químico. São necessárias reações de proteção e desproteção de grupos funcionais, ativação de fosfatos e controle estereoquímico para garantir a incorporação correta. Além disso, a estrutura do DNA é mantida por ligações fosfodiéster, que conectam os nucleotídeos, e conhecer a estabilidade e reatividade dessas ligações é fundamental para técnicas de clivagem (como as realizadas por enzimas de restrição) e de ligação (como na montagem de construtos genéticos).
Além da sequência de bases, modificações químicas como metilação e acetilação influenciam a expressão dos genes. Essas alterações epigenéticas são promovidas por enzimas específicas e têm aplicações em diagnósticos, terapias e controle de expressão gênica.
Engenharia Genética
 A engenharia genética também permite manipular proteínas por meio do DNA. O código genético traduz sequências de DNA em cadeias de aminoácidos, que se dobram em estruturas tridimensionais com funções enzimáticas. Alterações na sequência de DNA resultam em mudanças estruturais que afetam diretamente a atividade das proteínas.
A engenharia genética também permite manipular proteínas por meio do DNA. O código genético traduz sequências de DNA em cadeias de aminoácidos, que se dobram em estruturas tridimensionais com funções enzimáticas. Alterações na sequência de DNA resultam em mudanças estruturais que afetam diretamente a atividade das proteínas.
A mutagênese sítio-dirigida é uma técnica que utiliza primers modificados para substituir aminoácidos específicos em regiões de interesse. Com isso, é possível aumentar a eficiência catalítica, especificidade ou estabilidade de uma enzima.
Avanços em biologia sintética permitiram ainda a incorporação de aminoácidos não canônicos em proteínas. Utilizando sistemas artificiais de tRNA e aminoacil-tRNA sintetases, introduzem-se resíduos com grupos funcionais inéditos, ampliando o repertório funcional de enzimas para aplicações específicas.
Engenharia Genética Aplicada à Degradação de Biomassa
A lignocelulose é o principal componente estrutural das plantas, mas sua complexidade dificulta o acesso eficiente aos açúcares que ela contém. Essa estrutura é formada por celulose, composta por longas cadeias de glicose; hemicelulose, constituída por diversos tipos de polissacarídeos; e lignina, um polímero fenólico que atua como barreira protetora. Entre os principais desafios para sua degradação, destacam-se a resistência física imposta pela lignina à ação enzimática, a diversidade estrutural da hemicelulose que exige diferentes tipos de enzimas, e a influência de fatores como temperatura e pH sobre a estabilidade das enzimas utilizadas. Diante desse cenário, uma das estratégias promissoras envolve a otimização de coquetéis enzimáticos por meio da engenharia genética.
Um exemplo relevante nessa área é o trabalho realizado pelo Laboratório de Microbiologia e Biologia Celular da USP de Ribeirão Preto (LMBC), que tem como uma de suas frentes de pesquisa o desenvolvimento e aprimoramento de coquetéis enzimáticos voltados à degradação de biomassa lignocelulósica. Esse tipo de biomassa representa uma fonte renovável de energia com grande potencial, mas demanda uma ação enzimática coordenada e altamente eficiente para liberar os açúcares fermentáveis. Em um estudo conduzido pela professora Maria de Lourdes Morais Polizeli, investigou-se como diferentes condições climáticas simuladas — como o aumento da temperatura, a elevação dos níveis de CO₂ e a combinação desses fatores — influenciam a composição da biomassa e sua susceptibilidade à ação enzimática. Com base nesses dados, o grupo desenvolveu coquetéis enzimáticos personalizados para cada condição, incorporando não apenas enzimas celulolíticas convencionais, mas também proteínas acessórias como hemicelulases, LPMOs e expansinas, que melhoram o acesso à celulose e potencializam a eficiência da hidrólise.
Além da formulação de misturas adaptadas, outra linha de pesquisa promissora envolve a modificação do código genético de enzimas com potencial elevado, visando aprimorar características como atividade catalítica, estabilidade térmica e sinergia com outras enzimas. Essa abordagem permite gerar variantes enzimáticas com desempenho superior, que são então avaliadas experimentalmente quanto à sua eficácia e compatibilidade dentro dos coquetéis enzimáticos. Trata-se de uma estratégia racional e dirigida, que contribui para o desenvolvimento de soluções biotecnológicas mais eficazes.
Outro exemplo relevante vem do Centro Nacional de Pesquisa em Energia e Materiais (CNPEM), onde pesquisadores demonstraram como a engenharia genética pode ser aplicada para aumentar a produção de enzimas utilizadas na degradação de biomassa. Utilizando a cepa RUT-C30 do fungo Trichoderma reesei, conhecida por sua elevada capacidade de secreção de enzimas degradadoras da parede celular vegetal, o grupo implementou seis modificações genéticas utilizando a técnica CRISPR/Cas9. As alterações incluíram a edição de fatores de transcrição para intensificar a expressão gênica, a deleção de proteases responsáveis por degradar as próprias enzimas produzidas, e a introdução de genes codificadores de enzimas ausentes na cepa original. Como resultado, a produtividade enzimática atingiu até 80 g/L a partir de resíduos agroindustriais como a palha de cana-de-açúcar, representando mais que o dobro dos níveis anteriormente registrados.
Esse processo foi testado em escala piloto, demonstrando viabilidade tanto técnica quanto econômica. Além disso, o grupo identificou sete novas classes de enzimas com aplicações potenciais em diferentes setores industriais, incluindo os de biocombustíveis, alimentos e têxteis. Esses resultados reforçam como a integração entre genética, bioquímica e caracterização funcional pode gerar soluções inovadoras, explorando a diversidade natural de maneira orientada pela ciência.
Dessa forma, a engenharia genética, fundamentada na compreensão química das moléculas biológicas, permite o desenvolvimento de soluções sob medida para desafios industriais e ambientais. A sinergia entre química e biotecnologia continua sendo essencial para impulsionar inovações científicas com aplicação prática e impacto sustentável.

Thayssa Victória
Presidente da SQJr.